¿Qué hace la diferencia entre los enlaces iónicos y covalentes?
keiths
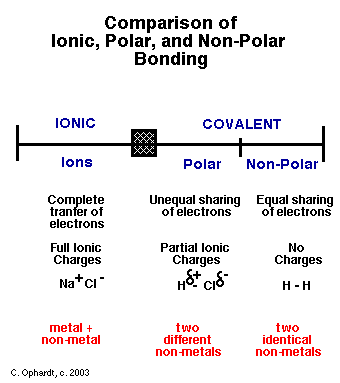
Trasfondo: cuando aprendí sobre las reacciones químicas, había dos tipos de enlaces moleculares: Iónico, donde un átomo o una molécula compuesta con un número de valencia bajo pierde esos electrones de valencia a uno o más compuestos con un número de valencia alto, que luego se une con; y covalente, donde los electrones de valencia se "comparten" entre dos o más átomos que no quieren realmente "ceder" sus electrones al otro átomo.
Al principio, eso funcionó. Pero luego, mientras hurgaba casualmente en Wikipedia y otros sitios buscando ampliar mi conocimiento, encontré evidencia que refutaba esta clara división. Por ejemplo, la explicación del pH en Wikipedia establece que el agua líquida pura, una sustancia que es un ejemplo de libro de texto de enlaces atómicos covalentes, en realidad no es covalente, sino una mezcla a partes iguales de hidronio (H 3 O + ) e hidróxido (OH - ) iones. La explicación es que el agua líquida, como solvente polar, en realidad se disuelve , y los iones de hidrógeno (protones desnudos) viajan con relativa libertad entre los átomos de agua en su estado líquido e incluso gaseoso, formando hidronio donde se gana el átomo de hidrógeno e hidróxido donde esta perdido.
Otro ejemplo; benceno. Está compuesto por 6 carbonos y 6 hidrógenos. El carbono quiere obtener cuatro electrones para llenar su capa de valencia exterior. El hidrógeno llena uno, aparentemente al compartir. Obtiene los otros tres compartiendo electrones con sus dos vecinos. Ahora, tres electrones no se dividen por dos; Clásicamente, se nos enseña que los enlaces dobles y simples se alternan, pero en realidad, el comportamiento de esta construcción indica que el último electrón de valencia de cada átomo de carbono se comparte entre sus dos vecinos, dando a cada carbono enlaces "uno y medio". con cualquiera de sus vecinos. Eso suena como "compartir", pero no en la forma normalmente descrita.
Ahora, hay otros ejemplos bastante concretos de covalencia; Las moléculas diatómicas de gas como el O 2 y el N 2 tienen cada una una capa de valencia mayormente llena y solo necesitan un par de electrones de valencia más, por lo que en sus enlaces diatómicos cada átomo "jala" los electrones de valencia del otro hacia su propia capa de valencia sin perder los suyos. . Pero, los enlaces "altamente covalentes" como este parecen ser más una excepción a la regla que una regla en sí misma.
Entonces, quizás desde un nivel más profundo, pregunto: ¿dónde está la "línea divisoria" entre los enlaces llamados "iónicos" y los enlaces llamados "covalentes"? ¿Existe una propiedad primaria del enlace o de la sustancia resultante que se pueda dar como evidencia para decir definitivamente "este es un (a) _ __ _ __ enlace? ¿O hay de hecho alguna "zona gris" donde el comportamiento de los electrones entre átomos podría describirse de las dos maneras al mismo tiempo?
Respuestas (3)
genero
La división en realidad no es entre covalente e iónico, sino un espectro entre electrones localizados y deslocalizados. La historia de todo esto es bastante fascinante, y Phil Anderson en su libro "Más y diferente" tiene un buen capítulo sobre esto. Esencialmente, en la época en que la gente comenzó a estudiar seriamente la mecánica cuántica de las moléculas, había dos escuelas de pensamiento que dominaban.
Por un lado estaba Mott y, más popularmente, Hund y Pauli, quienes pensaban que los electrones estaban unidos principalmente a los átomos y, a través de las interacciones electromagnéticas, sus movimientos/orbitales se deformarían y se obtendrían moléculas. Esta es la versión que generalmente se enseña en las clases de química, ya que con algunas reglas generales es posible dar cuenta cualitativamente de una amplia gama de comportamientos.
Por otro lado estaba Slater con el sueño de una máquina que simplemente pudiera calcular la estructura electrónica dándole los átomos y electrones. En esta imagen, se piensa principalmente que los electrones están deslocalizados sobre todos los átomos y, a través de un procedimiento riguroso de teoría de perturbaciones, se agrega el efecto de las interacciones entre electrones y se puede lograr una precisión arbitrariamente buena.
Este último tiene el problema de que los resultados no son intuitivos --- no hay reglas generales disponibles y uno se reduce a simplemente computar. El problema con el primero es que para lograr una alta precisión, las "reglas generales" se vuelven extremadamente complejas y no son muy fáciles de usar o de calcular --- carece de la regularidad simple de la máquina de sueños de Slater. Es revelador que esencialmente esto último haya ganado, y hoy en día es rutinario calcular la estructura electrónica de moléculas bastante grandes (~1000 átomos) a través de la fuerza bruta (la técnica se conoce como teoría funcional de la densidad, y hay software comercial disponible para hazlo).
En moléculas finitas, se puede demostrar que, en principio, ambos enfoques funcionarán; técnicamente, hablamos de que existe una conexión adiabática entre los estados localizado y deslocalizado. La única diferencia práctica es lo difícil que es realizar los cálculos. Sin embargo, en moléculas infinitas (por ejemplo, cristales sólidos) esto no es cierto y puede haber una transición de fase adecuada entre los dos puntos de partida. En ese caso, el enfoque localizado corresponde a lo que se llama elegantemente en estos días "sistemas fuertemente correlacionados", como los aisladores de Mott y los materiales ordenados magnéticamente, y el enfoque deslocalizado son esencialmente metales (lenguaje técnico: se vuelve a normalizar para ser un líquido de Fermi).
Hoy en día existe el deseo (de los físicos teóricos de la materia condensada) de desarrollar nuevamente el enfoque localizado, ya que es posible encontrar algunas reglas generales útiles con respecto a los materiales magnéticos, un ejemplo destacado de los cuales son los superconductores de alta temperatura.
matriz de dilitio
Buena pregunta. Los enlaces son definitivamente un espectro entre covalentes (donde los electrones se comparten aproximadamente por igual) e iónicos (donde una especie domina el control de los electrones). A veces, el término "covalente polar" aparece en algún punto intermedio. No hay una línea divisoria clara, pero en general la cantidad de interés es la polaridad de la molécula resultante. Altamente polar es característico de un enlace iónico, mientras que poca (o ninguna) polaridad es característica de enlaces covalentes.
Lo que determina la polaridad es la diferencia de electronegatividad entre los átomos que forman el enlace.
Consulte esta página web para obtener mucha información útil sobre el tema: http://www.chemistry.mcmaster.ca/esam/Chapter_7/section_1.html
Manishearth
Tienes toda la razón, no hay línea divisoria.
Electronegatividad
Para los enlaces covalentes, tenemos algo conocido como electronegatividad .

En esta molécula de HCl (gaseoso puro), hay un enlace covalente H-Cl. Recuerda que un enlace es básicamente una nube de electrones. Ahora, el cloro tiene una alta electronegatividad (léase: afinidad por los electrones), y la forma de la nube de electrones está distorsionada hacia el cloro. Así, el HCl, un compuesto covalente (en estado gaseoso), se convierte en un compuesto parcialmente iónico. Si lo pones en agua, las fuerzas intramoleculares son lo suficientemente grandes (y es lo suficientemente estable) que se rompe en iones.
Entonces, los enlaces covalentes asimétricos tienen un poco de naturaleza iónica. Los electrones no están perfectamente compartidos, una de las moléculas los acapara.
Polarización
Por otro lado, para compuestos predominantemente iónicos, tenemos algo llamado polarización . En las redes cristalinas iónicas, idealmente, los iones positivos y negativos tienen bonitas nubes redondas. Pero, debido a las diferencias de tamaño/carga, estas nubes también pueden distorsionarse, lo que lleva a una pequeña superposición. Superposición = enlace covalente, por lo que ahora tenemos un carácter covalente parcial en un enlace iónico.
idea aproximada
Una forma de distinguirlos aproximadamente son los principios de Fajan (IIRC pronunciado sin la 'J')
Es posible que haya notado que la polarización y la electronegatividad son prácticamente lo mismo, solo que en extremos opuestos.
OK, ahora algunas cosas en sus ejemplos:
Agua
El agua pura no es solo iones se trata solo de moles de cada uno por litro de agua. El resto es simple, en condiciones de servidumbre .
Benceno
Los carbones de benceno no comparten los electrones solo con sus vecinos cercanos. Todos se comparten electrones.

Aquí todos los electrones de los dobles enlaces (seis de ellos) se vierten en la nube de dos lóbulos que ves en el diagrama. Las nubes de electrones son objetos mecánicos cuánticos y, por lo tanto, todo lo que dicen es "hay una probabilidad xyz de encontrar un electrón aquí". Y el electrón podría ser de cualquiera de los carbonos, IIRC no hay una característica distintiva (número cuántico) que te diga de qué carbono provienen, debe haber algunos otros números cuánticos, pero no lo sé, pero lo harán. probablemente sea aleatorio y no esté relacionado con el átomo de carbono.
Llang
Spin-1212\frac{1}{2} partículas en química
¿Cuáles son las razones físicas de las reacciones químicas? [cerrado]
Transiciones de dipolo eléctrico/valor esperado de posición
Cálculo con números cuánticos y forma de capas nodales
Notación para estados electrónicos de moléculas.
Ion H2+: ¿Qué elementos de la matriz hamiltoniana se desvanecen en función de la simetría?
¿Cuál es la relación entre el radio de Van der Waals y la longitud de Van der Waals?
¿Los anillos enlazados cuánticamente de nudos cuánticos tienen energía?
Reglas de selección en espectroscopia rotacional- molécula de agua
Ángulos de enlace - H2O vs CO2
Enrique
david z