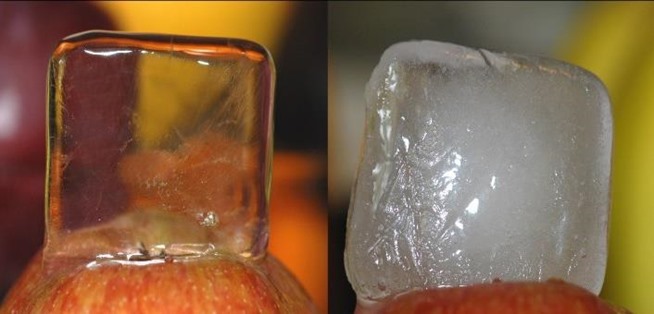
¿Por qué el hielo hecho de agua hervida es transparente?
dk2ax
Respuestas (3)
Anterior
La respuesta corta: el hielo nublado es causado por gases (principalmente nitrógeno y oxígeno) disueltos en el agua que salen de la solución cuando el agua se congela. Las pequeñas burbujas atrapadas en el hielo provocan la apariencia blanca. Hervir el agua elimina el aire disuelto en ella, produciendo como resultado hielo claro. Suponiendo que otras impurezas no produzcan el mismo efecto turbio.
La respuesta larga:
Impurezas presentes en el agua:
Gases: El agua a 20°C normalmente contiene alrededor de 15 ppm de gases disueltos, lo que equivale a 1 volumen de aire por 50 volúmenes de agua. Son los mismos gases presentes en el aire, pero no en las mismas proporciones ya que unos son más solubles que otros: se trata de un 63% de nitrógeno, un 34% de oxígeno, un 1,5% de argón y un 1,5% de dióxido de carbono.
Minerales: El agua del grifo contiene minerales disueltos, principalmente Ca y Mg. Pueden estar presentes en forma de bicarbonatos: y (estos solo existen en solución, no como sustancias sólidas), y como sulfato de calcio y magnesio. Si el agua pasó a través de un ablandador de agua, los iones de Ca y Mg pueden haber sido reemplazados por (el doble) de iones de sodio o potasio.
Los efectos de calentar el agua:
eliminación de gases disueltos: una mayor temperatura favorece las reacciones endotérmicas ( principio de Le Chatelier ). Para los gases presentes en el agua, la disolución (a temperatura ambiente) es un proceso exotérmico, por lo que su solubilidad disminuye cuando se calienta el agua. La solubilidad de los gases no llega a cero en el punto de ebullición, ni tampoco disminuye necesariamente en todo el rango de temperatura. Para el nitrógeno en agua, la entalpía de disolución se vuelve positiva alrededor de los 75° y su solubilidad aumenta por encima de esa temperatura. A 100°C, la solubilidad del aire como un todo es , aproximadamente la mitad de la solubilidad a 10°C, .
Eliminación de minerales disueltos: calentar el agua promueve la conversión de bicarbonatos de Ca y Mg solubles en carbonatos insolubles ( → ) que saldrá de la solución (como cal). Los sulfatos (a veces denominados "dureza permanente") y los (bi)carbonatos de sodio o potasio permanecen en solución.
El efecto de la ebullición:
- La solubilidad del gas en líquido no solo depende de la temperatura, sino que es directamente proporcional a la presión parcial del gas. Al hervir, la fase gaseosa en contacto con el agua ya no es el aire, sino el vapor de agua (en las burbujas y cerca de la superficie). En esas burbujas, la presión parcial de los gases será cercana a cero, por lo que las moléculas de gas seguirán saliendo de la fase líquida (y el aumento de la superficie y el movimiento del agua aceleran el proceso), pero casi ninguna regresará. Dado el tiempo suficiente, el vapor de agua eliminará la mayor parte del gas. La ebullición es básicamente el equivalente a la desgasificación mediante purga: eliminar un gas (normalmente oxígeno) de un disolvente haciendo burbujear un gas inerte a través de él.
¿Cómo los gases hacen que el hielo sea "lechoso/turbio"?
- Durante la congelación, la capa de hielo comienza en todos los lados del cubo y crece hacia adentro. Las moléculas de agua encajan en la red cristalina y se adhieren a ella, otras moléculas no (pero si el hielo crece más rápido de lo que las moléculas de gas pueden difundirse, quedarán atrapadas). La concentración de gases (y otras impurezas) en el líquido restante aumenta, la solución se sobresatura y comienzan a formarse microburbujas. Todos estos quedan atrapados en el hielo, dándole una apariencia lechosa.
dk2ax
Selene Routley
¡Realmente estoy improvisando esto porque la última vez que hice un cálculo de equilibrio fue hace 35 años! Pero estoy bastante seguro de una respuesta parcial (ver discusión al final).
La solubilidad de un gas en agua (o líquido en general) casi siempre disminuye al aumentar la temperatura. Este fenómeno se explica de una manera muy parecida a la explicación del aumento de la tasa de evaporación de un líquido con la temperatura. Los gases se disuelven en líquidos porque las moléculas de gas encuentran un estado de menor energía unidas al líquido. Cuanto mayor sea la temperatura, mayor será la proporción de moléculas de gas con energía térmica mayor que la energía de enlace para el proceso de disolución. Entonces, una mayor proporción de las moléculas de gas puede escapar del líquido: el equilibrio químico para la reacción de disolución cambia para favorecer a las moléculas libres más que a las unidas a medida que aumenta la temperatura.
La ebullición de un líquido reduce la concentración de gases disueltos a través del efecto anterior. Normalmente, el cambio de equilibrio hacia atrás para favorecer los gases disueltos con una temperatura decreciente significaría que, al enfriarse, el líquido absorbería tanto gas como el que se expulsa en el proceso de ebullición. El truco con el hielo claro es que el líquido se congela demasiado rápido para que se complete el proceso de disolución del gas (se congela de manera irreversible , por lo que está muy lejos del equilibrio a medida que se enfría), con el resultado de que hay una expulsión neta de gas del hielo. el líquido por ebullición antes del proceso de congelación. Una vez que el líquido se congela, el gas ya no se puede disolver en él, por lo que tiene hielo transparente.
Tenga en cuenta que esta respuesta está incompleta: no responde por qué el gas disuelto en el líquido forma las burbujas que hace cuando el líquido se congela, como en la imagen de la derecha de su pregunta. Esta respuesta solo explica la ausencia del gas necesario para el proceso de enturbiamiento, por lo que una respuesta completa debe explicar por qué el gas disuelto sale de la solución para formar burbujas cuando el hielo se congela.
Anterior
zwol
mike scott
J...
JDługosz
Selene Routley
Selene Routley
Selene Routley
J...
neil
Xylius
dk2ax
Carel
Esta respuesta fue pensada como un comentario para @WetSavannahanimal, también conocido como Rad Vance, pero es bastante larga y alcancé el límite de caracteres.
La razón del centro opaco debería deberse a la forma en que se congela el volumen de agua. Presumiblemente, la solución no se mezcla y el exterior se congela primero formando una pared cristalina (hielo) a través de la cual el gas no puede escapar. A medida que la pared se espesa, se libera gas del agua que se solidifica en la solución central que queda. Esto concentra el gas en el líquido restante en el centro. Cuando la concentración de gas en esta solución alcanza el valor de saturación del líquido en su estado actual, parte de él sale de la solución formando las cavidades, simultáneamente se debe formar algo de hielo, devolviendo la solución a la concentración de saturación. Esto se repite hasta que toda el agua esté congelada.
La observación de que se forma hielo transparente con gas burbujeante a través de él mientras se congela, indica que la mezcla de la solución permite que los gases saturados escapen de la superficie del volumen total de agua a medida que se forma el sólido en lugar de formarse en el centro.
Ahora uno podría preguntarse por qué no hay una sola burbuja. La primera razón, desde el punto de vista de una solución a granel, es que el agua se congela gradualmente formando burbujas a medida que avanza. Realmente está oscilando sobre el estado de equilibrio de la solución, que es el punto de saturación de gas de la solución de congelación. Las condiciones exactas de este punto variarán ligeramente a medida que el líquido se congele. La presión a la que se congeló el hielo en el centro es probablemente mayor que la presión a la que se congeló el hielo de la superficie, por ejemplo, de manera similar, la temperatura a la que se congeló también podría variar. Probablemente también haya un efecto de concentración, es decir, a medida que este punto de equilibrio se desplaza, el punto de saturación del gas se desplazará, este cambio en la concentración también afecta un poco al punto de congelación. Hay alrededor de cuatro efectos (temperatura, presión, volumen y concentración de gas) en juego durante la congelación. El segundo efecto, desde el punto de vista de un volumen finito, es que localmente alrededor de la cavidad el agua podría experimentar una "oleada de gas" que podría congelar localmente una película de agua que encapsula la burbuja, por lo tanto, la compleja disposición final de las cavidades y no la formación. de una sola burbuja.
Ahora podría ser posible ver estas diferencias en el punto de congelación usando el truco del polarizador. Solo he visto esto con plásticos transparentes hasta ahora, pero también debería funcionar aquí. La próxima vez que vayas al cine, consigue un par de gafas 3D. Saque las dos lentes polarizadoras y sosténgalas a cada lado del cubo de hielo girándolas un poco, debería ver la estructura cristalina interna del hielo como un lío de líneas arremolinadas. Probablemente debería ver más un remolino o una dispersión en el centro cerca de las burbujas que indican los cambios localizados en la estructura del cristal. Debes comparar esto con el cubo transparente.
Hay otro truco que puedes probar. Si controlaras la congelación del hielo hasta cierto punto, podrías controlar la formación de burbujas. Por ejemplo, nuestras bandejas de hielo son de plástico y tendemos a tener una capa superior transparente con burbujas que se forman en la parte inferior del cubo. Sospecho que el plástico retiene su calor y retrasa la congelación del fondo y el costado del cubo. Sospecho que si uno calienta o incluso enfría la bandeja de hielo antes de formar el hielo, podría ver una formación diferente de cavidades (como se muestra en la segunda imagen aquípor ejemplo). Si usó una bandeja de hielo de metal, debería ver el efecto que ha observado. Si combinó una bandeja de hielo de metal y una de plástico, es posible que obtenga más burbujas más cerca del lado de plástico. Incluso podría obtener un efecto de lunares/explosión/manchas al colocar pegamento dentro de una bandeja de metal o sostener una barra de metal dentro del volumen mientras lo congela. Aunque solo podría estar agregando puntos para que el gas se forme y escape, lo que da como resultado cubos claros. Alternativamente, puede obtener un carrat (sombrero) . Este compañero parece haber hecho mucho del trabajo preliminar por usted. Beneficiosamente, parece disfrutar bebiendo sus experimentos después (YMMV).
Si está realmente interesado, debería ver si la NASA realizó algún experimento de congelación en el espacio, podría mostrar otros métodos mediante los cuales se podría controlar la formación de burbujas. Del mismo modo, es posible que encuentre imágenes congeladas de cámaras de alta velocidad durante las cuales debería ver algunos efectos interesantes a medida que se forman las burbujas (aunque es un uso un poco contradictorio de estas cámaras y dudo que las personas que las poseen hayan pensado en usarlas para este propósito ).
Explicación del rocío helado
¿Por qué el agua congelada revienta una tubería?
Termodinámica del agua sobreenfriada
¿Cuál es el estado de las investigaciones del efecto Mpemba?
¿Por qué mi refresco líquido se congeló una vez que lo saqué del refrigerador?
Copos de hielo en leche congelada y jugo de naranja
¿Por qué aplastar una botella de agua mantendrá el agua en estado burbujeante? [duplicar]
¿Por qué al golpear una bolsa de agua fría se congela?
Agua salada y hielo, frente a agua corriente y hielo
¿Puede hervir un líquido en un recipiente cerrado?
Steven
dk2ax
Bakuriú
dk2ax
dk2ax
paparazzi
dk2ax
Loco
dk2ax
Anterior
JDługosz
usuario10851
David Richerby
Jim
dk2ax
dk2ax
David Richerby
Jim