El núcleo de Júpiter es hidrógeno sólido
Kevin
Estaba viendo un programa en el canal científico sobre gigantes gaseosos; hay algo que no entiendo. No soy un científico, por lo que esto puede ser obvio para algunos. Aprendí que hay tres estados de un objeto físico dado; sólido, líquido y gas dependiendo de qué tan frío o caliente esté el objeto. Un ejemplo sencillo es el hielo, el agua y el vapor de más frío a más caliente. Entonces, la teoría es que Júpiter tiene un núcleo sólido supercalentado y muy denso que está compuesto de hidrógeno. ¿Cómo un gas como el hidrógeno se vuelve sólido mientras se sobrecalienta? ¿Es que la presión es tanta que el gas se comprime en un sólido? Si es así, ¿cuánta presión se necesita para comprimir hidrógeno en un sólido? ¿Cómo juega el calor en la ecuación?
Respuestas (2)
jerry schirmer
Primero, antes de continuar, debemos entender la presión. Imagínese amontonando arena sobre usted en la playa, solo una pequeña capa, no siente mucho peso, pero a medida que se entierra más y más profundamente, siente más y más fuerza empujando hacia abajo. Esto tiene sentido, ya que tu cuerpo tiene que soportar el peso de toda la arena encima de ti.
Es exactamente lo mismo en la atmósfera de Júpiter: la capa más baja de gas tiene que soportar todo el peso del gas encima, lo que significa que el núcleo tiene una presión increíblemente grande. Los gases presurizados tienden a volverse líquidos o sólidos, piense en las latas de aire que compra para quitar el polvo, si las vierte, hay líquido adentro, porque el aire está presurizado en un fluido.
Pero también tiene razón al señalar que la compresión de fluidos tiende a calentarlos y que las cosas más calientes tienden a evaporarse/derretirse. Entonces, la pregunta es qué tendencia gana en este caso. Y para eso, la herramienta más útil que tenemos es un diagrama de fase. A continuación, tenemos uno para el dióxido de carbono. (fuente: wikipedia):
Observe que, a presiones muy altas, el estado sólido es dominante, incluso cuando la temperatura es alta. De hecho, el núcleo de Júpiter tendrá una presión muy alta.
Tenga cuidado con los diagramas de fase del agua. En muchos sentidos, el agua es una molécula atípica. no polar es mucho más parecido a de lo que es al agua.
Ignacio Vázquez-Abrams
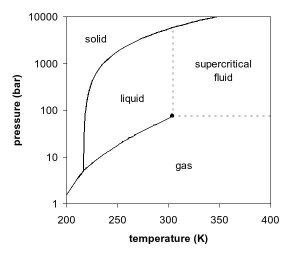
Aquí está el gráfico de fase de una sustancia que llamaremos "Unobtanium". Es similar al de Hidrógeno, aunque no exactamente igual:
Como puede ver, a medida que aumenta la presión, también aumentan los puntos de ebullición y fusión; esto permite que la sustancia permanezca sólida o líquida a temperaturas mucho más altas que a la presión estándar.
¿Por qué Júpiter es gaseoso en lugar de sólido o líquido?
¿Hay predicciones publicadas de que el hidrógeno podría permanecer metálico a presión ambiental?
¿Por qué no hay regulador de presión en los tanques de helio/hidrógeno?
Para la producción recientemente informada (enero de 2017) de hidrógeno metálico en el laboratorio, ¿cuál es exactamente la evidencia?
¿Cuáles son los posibles cambios para la física futura debido al descubrimiento del hidrógeno metálico?
¿El helio en los neumáticos de una bicicleta la hará más liviana?
sensor de presión diferencial da resultado oscilado
¿Qué sucede si el electrón enlazado del átomo de hidrógeno gana energía cinética excede la energía de enlace?
¿Por qué la fuerza debida al vacío en una jeringa es mucho mayor que la fuerza debida al aire comprimido en la jeringa?
¿Es un protón libre un ion positivo de hidrógeno-1?

Ignacio Vázquez-Abrams
Arnold Neumaier
jerry schirmer
jerry schirmer